Münster (upm/dn) – Die Behandlung von Patienten mit akutem Lungenversagen stellt die Intensivmedizin immer wieder vor große Herausforderungen. Meist liegt eine Lungenentzündung zugrunde, die durch eine Infektion mit Bakterien oder – insgesamt seltener, durch die Corona-Pandemie aktuell aber häufig zu beobachten – durch eine virale Infektion ausgelöst wird. Dabei wandern Zellen des Immunsystems – die weißen Blutkörperchen – in die Lunge und bekämpfen die Erreger. Gleichzeitig verursachen sie aber auch „Kollateralschäden“ im Lungengewebe. Löst sich die Entzündungsreaktion nicht rechtzeitig wieder auf, kann eine chronische Entzündung mit dauerhafter Funktionseinschränkung der Lunge die Folge sein. Gemeinsam mit Kolleginnen und Kollegen aus London, Madrid und München hat ein Forschungsteam um die Anästhesisten und Intensivmediziner Prof. Dr. Jan Rossaint und Prof. Dr. Alexander Zarbock von der Westfälischen Wilhelms-Universität (WWU) Münster jetzt neue Erkenntnisse zu zellulären Vorgängen bei bakteriellen Lungenentzündungen gewonnen: In einer Studie mit Mäusen fanden die Forschenden heraus, dass Blutplättchen und ihre Interaktion mit bestimmten weißen Blutkörperchen – den regulatorischen T-Zellen – eine bedeutende Rolle dafür spielen, dass sich die Entzündung auflöst. Die Studie ist in der Fachzeitschrift „Journal of Experimental Medicine“ erschienen.
Blutplättchen sind Partner regulatorischer T-Zellen und senden Signale an Fresszellen
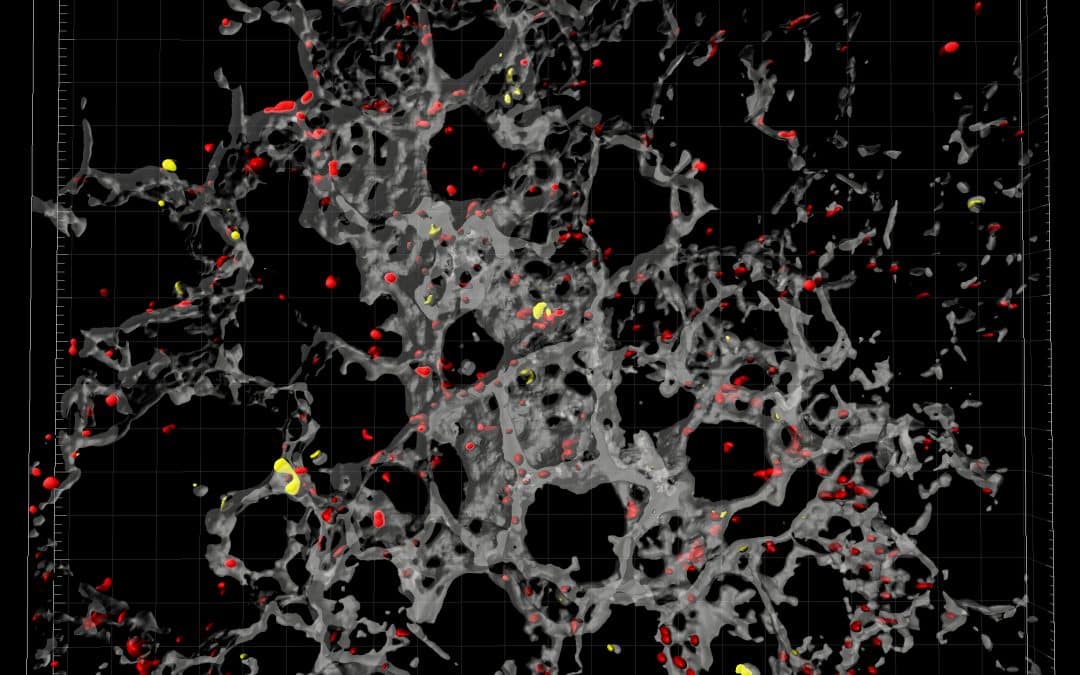
Bereits bekannt war, dass Blutplättchen zu Beginn einer Entzündungsreaktion in der Lunge (Lungenentzündung), aber auch in anderen Organen, mit neutrophilen Granulozyten zusammenarbeiten – einer Untergruppe weißer Blutkörperchen, die darauf spezialisiert ist, Krankheitserreger abzuwehren. Die Wissenschaftler zeigten nun erstmals, dass die Blutplättchen im weiteren Verlauf der Entzündung an die regulatorischen T-Zellen binden und dass dies die Voraussetzung dafür ist, dass die T-Zellen – in einer Einheit mit den Blutplättchen – in die Lunge an den Ort der Entzündung wandern. Dort sondern sie gemeinsam anti-entzündliche Botenstoffe ab, durch die Makrophagen in der Lunge neu „programmiert“ werden. Diese als Fresszellen bekannten weißen Blutkörperchen lotsen dann keine weiteren neutrophilen Granulozyten mehr an den Ort der Entzündung, sondern beseitigen die nun nicht mehr benötigten neutrophilen Granulozyten. Dies unterstützt das Abklingen der Entzündung und verhindert weitere Gewebeschäden.
Suche nach neuen Therapiekonzepten bei Lungenentzündung
„Wenn wir Patienten mit akutem Lungenversagen behandeln, können wir die Lungenfunktion mit verschiedenen Maßnahmen unterstützen und setzen darauf, die verursachenden Erreger beispielsweise mit Antibiotika zu bekämpfen“, erklärt Jan Rossaint. „Uns fehlen aber weitere Therapiemöglichkeiten, mit denen wir gezielt bei den Ursachen ansetzen und regulierend in den Verlauf einer Entzündung eingreifen können“. Die aktuellen Untersuchungen stellen eine Grundlage für solche Therapiekonzepte dar. In weiteren Schritten möchten die Forschenden überprüfen, ob die von ihnen bei Mäusen beobachteten Entzündungsmechanismen auch bei Menschen auftreten, und nach Ansatzpunkten suchen, um konkrete Therapien zu testen.
Die Studie wurde von der Deutschen Forschungsgemeinschaft gefördert, unter anderem über die Klinische Forschungsgruppe 342 „Organdysfunktion im Rahmen systemischer Inflammationssyndrome“ der WWU, und erhielt weitere finanzielle Unterstützung durch die Deutsch-Israelische Stiftung für Wissenschaftliche Forschung und Entwicklung.
Link zu PubMed







 Der Notfalldienst ist über die kostenfreie Rufnummer:
Der Notfalldienst ist über die kostenfreie Rufnummer:
